近日,河南省脑靶向生物纳米药物重点实验室尹金龙教授课题组针对脑胶质瘤侵袭难题发现了新的治疗靶点及机制,纳米靶向该靶点可有效抑制肿瘤的侵袭和发展,相关成果发表于Nature Communications(中科院一区Top,IF=17.694)。
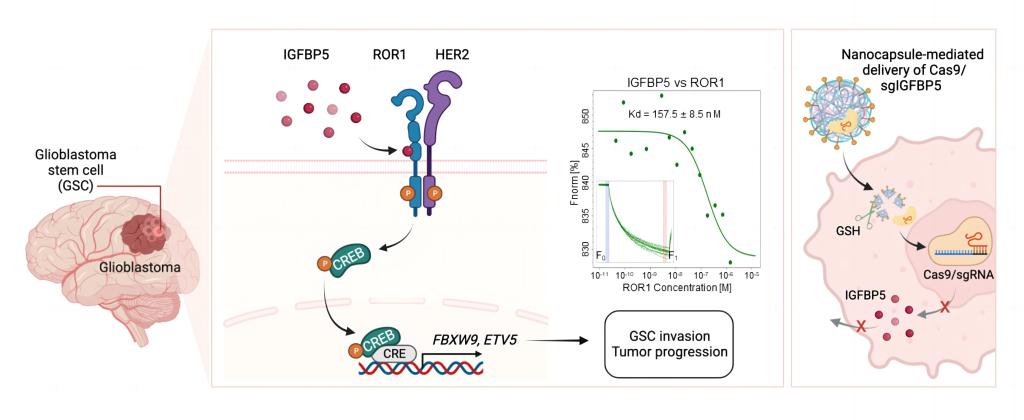
弥漫性浸润是胶质母细胞瘤(GBM)治疗耐药和复发的主要原因。在GBM中存在一类具有干细胞特性的细胞群:胶质母细胞瘤干细胞(GSC),是GBM肿瘤形成、发生发展、浸润侵袭、复发和导致放化疗抗性的根本原因。然而针对GSC侵袭性的具体分子机制及应用于靶向治疗的可行性仍不清楚。在此,尹金龙团队发现胰岛素样生长因子结合蛋白5(IGFBP5)是受体酪氨酸激酶样孤儿受体1(ROR1)的配体,是GSC侵袭的一个重要且具有应用前途的靶点。在体外和体内,特别是在患者来源的异种移植动物模型中,IGFBP5敲低抑制了GSC的侵袭能力。机制上IGFBP5与ROR1结合并促进ROR1/HER2异二聚体的形成,诱导CREB的磷酸化并在转录水平调控ETV5与FBXW9的表达,从而促进GSC的侵袭和肿瘤生长。同时,利用实验室开发的智能脑靶向纳米胶囊介导的CRISPR/Cas9 IGFBP5基因编辑可显著抑制GSC的侵袭和下游基因表达,并延长了GBM原位荷瘤小鼠的生存期。综上表明IGFBP5通过ROR1/HER2-CREB信号轴调控GBM的侵袭及肿瘤恶性进展,为GBM治疗提供了新的治疗靶点和思路。
该研究成果以“IGFBP5 is an ROR1 ligand promoting glioblastoma invasion via ROR1/HER2-CREB signaling axis”为题发表在Nature Communications期刊。金沙集团wwW3354CC博士研究生牛瑞、邹艳教授、韩国国立癌症中心蔺薇薇、Seong-Min Park、Sung Soo Kim为该论文的共同第一作者。冰洋教授、韩国国立癌症中心Jong Bea Park教授、尹金龙教授为共同通讯作者。该研究得到了国家自然科学基金、金沙集团wwW3354CC双一流建设经费的资助。
河南省脑靶向生物纳米药物重点实验室依托于金沙集团wwW3354CC和药学院。该实验室于2015年9月筹建金沙集团wwW3354CC-麦考瑞大学生物医学联合创新中心,随后相继获批河南省纳米生物医学国际联合实验室(2016年)、河南省生物纳米医学学科创新引智基地(2018年),并于2020年11月经河南省科学技术厅批准建设河南省重点实验室。实验室专注于脑部疾病的机制研究、新型诊疗系统的开发及脑部疾病靶向治疗,在脑部疾病新治疗靶点的筛选及输送策略机制研究、脑部诊疗系统开发及应用、脑部递送系统构建、脑靶向纳米药物临床前评估及转化等领域取得一系列研究成果,推动了金沙集团wwW3354CC生物学与相关学科的交叉融合及“生物学+”的发展。
论文链接:https://www.nature.com/articles/s41467-023-37306-1



